Lori di Papua Charmosyna papou (Scopoli)
Lori di Papua Charmosyna papou (Scopoli)
Altri nomi: Papuan lory (GB), Papualori (D), Lori de cola larga (E), Perkici papua (Indonesia), Papoea lori (NL), Papualori (D), Lori papù (F).
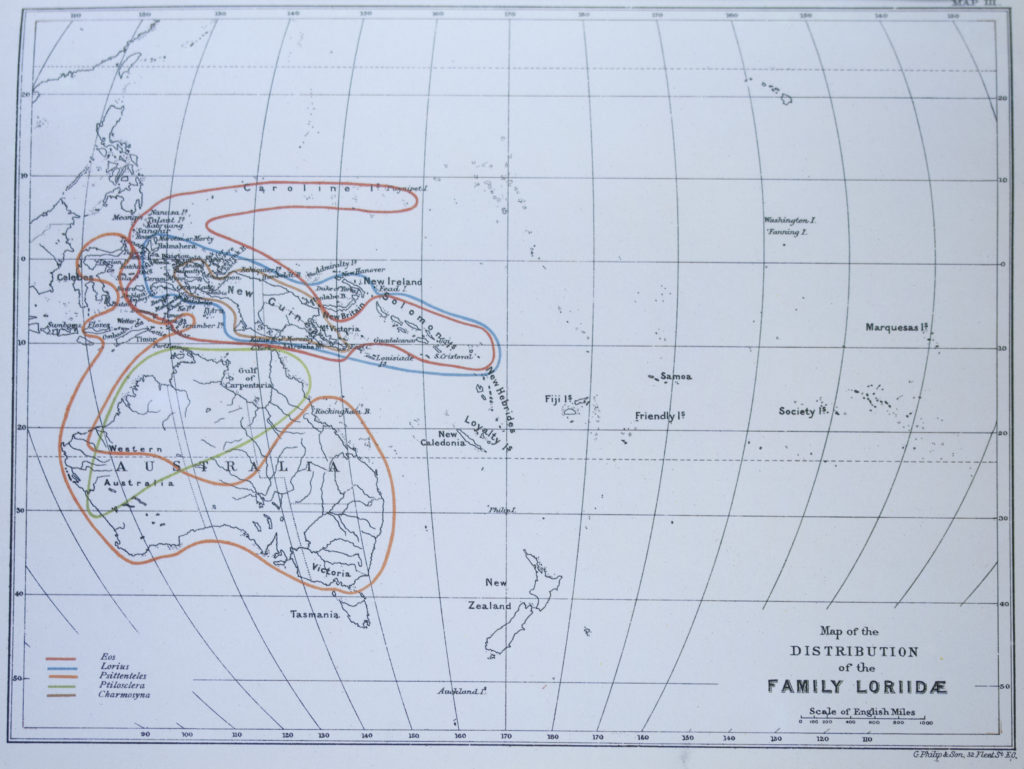 cartina geografica distribuzione lori
cartina geografica distribuzione lori
Charmosina dal greco kharmousunos , che vuol dire contento, gioioso. Papou, originario dell’isola di Papua, Nuova Guinea.
Nel 1734, venne chiamata dal farmacista zoologo olandese Albertus Seba, Avis paradisiaca orientalis (Thes.i.t.60.figs.1,2) e successivamente dal botanico e naturalista tedesco Jacob Theodor Klein, Pica paradisi (Hist.Av.63), solo nel 1750 il Latham lo definì un Lori, Papuan lory (Syn.i.p215,with varr.A.B.C._
Ebbe molte attribuzioni dagli studiosi sistemisti dell’epoca, solo Bonaparte la classificò Charmosina papuensis , nel 1850 (Consp.Av,ip.3 ).
Questa è una specie molto proporzionata nei Lori che è da più tempo conosciuta, essendo stata descritta in primis da Albertu Seba (1665-1736), farmacista e zoologo olandese. Tale pappagallo, per la sua siluette curiosa, spinse gli indigeni a cacciarla e, una volta preparata all’imbalsamazione, la usavano per adornarsi il capo. Trova riscontro tutto questo nel ‘Catalogo degli uccelli delle isole tropicali & c. pag.32’, lavoro scritto da G.R.Gray sull’ habitat della New Ireland.
Anche il Dr. Otto Finsch, etnografo , naturalista ed esploratore tedesco, nel suo libro sulla Nuova Guinea a pag.157, parla dell’isola Waigiou (7), ove era possibile avvistare il Lori papuano e molte rare specie.
Oggi il concetto tassonomico accettato dalle autorità, sin dal 1996 è: Charmosyna papou.,numero tassonomico seriale 554831.

Dopo molti anni di assenza nell’allevare Loridi, mi sono riuscito ad avvicinare ad una stupenda coppia di Lori papuani, grazie all’interessamento del Dr.Fabio Pelicella, vetrerinario e ottimo conoscitore ed allevatore di questa specie, il quale mi fatto da tramite con la Signora Gloria Di Fusco, la quale mi ha amorevolmente ceduto una coppia stupenda di Lori ed a cui mi sono apprestato a porla in riproduzione. Coppia che comunque aveva già deposto per la prima volta in questa stagione, ma a causa delle temperature molto alte di quest’anno, non sono riuscite a portare a compimento la covata.
Spero che presso il mio aviario ed in questa stagione, settembre – novembre, in condizioni di temperatura ottimali e in voliera molto lunga, possano esservi dei risultati positivi.
La voliera in zona abbastanza riparata rivolta verso la vegetazione del boschetto dalle dimensioni di sei metri di lunghezza, due di altezza ed 1,30 di larghezza, è coperta per un terzo, in cui vi è posto il nido. Gli alberi di alto fusto fanno ombra, creando le condizioni di fresco per il periodo estivo e di una temperatura adeguata per l’inverno, in sintesi per cercare di riprodurre in condizioni simili ai luoghi di origine di alta montagna tropicale dei 2500 m di altitudine. Fresca , riparata con molta vegetazione, con raggi solari che penetrano verso una parte della voliera; pertanto i Lori papua sono considerati animali robusti e resistenti, abituati a vivere sugli altopiani della Nuova Guinea, che sono nuvolosi e freddi per la maggior parte del tempo.

Il nido dalle dimensioni di 15x 15 x 30 cm, posto in posizione protetta, isolata alla vista di altri soggetti presenti nelle immediate vicinanze, anche “umani”ed è quasi camuffato da fogliame di eucaliptus gunni e passiflora.
E’ necessario che il materiale sia di legno, perché a causa delle feci , si crea all’interno un elevato tasso di umidità, che potrebbe bagnare il piccolo e farlo morire di freddo. Una escamotage potrebbe essere di porre sul fondo una fitta rete e poi mettere un alto strato di trucioli naturali , così da avere una evacuazione senza trattenuta di liquidi. In natura nidificano all’interno di piante epifitiche (2) che ne assorbono i liquidi, altrimenti è opportuno dotare il fondo di un cassetto estraibile, per potere controllare lo status della lettiera , senza disturbare i giovani.
I pulcini lasciano il nido dopo circa sessanta giorni e l’agitazione dei genitori è facilmente visibile; li nutrono ancora per due tre settimane. Nella valutazione di R.Low i giovani fratelli dovrebbero essere separati all’età di cinque mesi, per evitare che formino uno stretto legame.
L’alimentazione svolge per questi pappagalli un ruolo importante, molti sono oggi i mangimi che il commercio offre, ma bisogna assolutamente offrire una pappetta a secco o in umido, con cambio giornaliero, senza che lo stesso venga variato nella composizione e per questo motivo proseguo con il pasto che la stessa signora Gloria, ha già sperimentato. In separata ciotola aggiungo vari frutti di pera, pesca, mela e acini d’uva, poi vegetali come cetrioli, zucchine, verdure; bacche di piracanta, rosa canina, sorbo selvatico, sambuco nigra, spinaci, foglie di dente di leone, fiori di ibisco; rami freschi con fluorescenze, se disponibili;. da escludere assolutamente l’Avocado, tossico per i psittacidi.
Ottimi i melograni che da un punto di vista dietetico hanno un valore qualitativo eccellente. Apprezzato il polline ed il nettare naturale. Accettate le verdure come lattuga e spinaci. Infine bisogna fornire loro qualche proteina , quali vermi, formiche o larve come quelle del tenebrio(6), ma non nel momento di riproduzione e con parsimonia. Gradita l’uva sultanina , ma servita , dopo averla posta in acqua tiepida per farla rinvenire !
Bisogna comunque ricordarsi che tutti i lori hanno un metabolismo più veloce di altri pappagalli e che il cibo liquido viene assorbito molto velocemente ! Cibo che liquido và servito caldo tre volte al dì.
Usare un contenitore in acciaio inossidabile che viene lavato e sostituito ogni giorno.
Depongono, dall’età di due anni, generalmente due uova che schiudono dopo 28 giorni di incubazione. I pulcini vengono alimentati per 8 – 9 settimane giorni, prima che vadano all’involo. I giovani successivamente iniziano ad essere indipendenti dopo 2 o 3 settimane.
Detto questo mi preparo ad affrontare la stagione della riproduzione con attenzione.
Il colore del becco incide molto sullo stato di salute del pappagallo, se intenso arancione è segno di un ottima salute, se invece di tenue colore,con piume non compatte, potrebbe essere un segnale di mal nutrizione da attribuirsi a malattie epatiche. In compenso, se ben curato nella alimentazione, il fegato di questi lori ha grandi poteri di recupero e nel giro di tre mesi si possono notare gli effetti positivi.
Endemico della Nuova Guinea, 36-42cm, compresi i filamenti delle coda; 23-25 cm ,escluse le timoniere è uno degli esemplari più belli del mondo. Snello e di medie dimensioni, è caratterizzato da due fasi cromatiche e dalle remiganti e dalle timoniere esterne lunghe e filiformi, lunghe il doppio rispetto alle timoniere laterali e particolarmente evidenti in volo. Questa specie è inoltre caratterizzata dal dimorfismo sessuale in tre delle sue quattro sottospecie. Nella nominale, maschio e femmina sono identici e questa sottospecie, che si trova esclusivamente sui rilievi di (1) Vogelkop (Kepala Burung in lingua originale), Irian Jaya (Indonesia), non presenta la fase melanistica (3). Si distingue dalle altre sottospecie grazie al giallo ai lati del petto e sui fianchi. Ha pileo nero, leggermente striato di blu, striscia nera sulla nuca, parti superiori verdi, testa e parti inferiori di colore rosso con ventre nero. Le due sottospecie che abitano la Nuova Guinea centrale sono simili, caratterizzate sia dal dimorfismo sessuale, sia dalla fase melanistica, in cui il rosso e il giallo della livrea sono sostituiti dal nero, i maschi della fase melanistica presentano tuttavia tracce di rosso sul dorso e sulle sottocaudali. A differenza della nominale, non presentano le striature gialle sulle parti inferiori e le femmine hanno un’evidente macchia gialla sulla parte inferiore del dorso. La sottospecie che si trova nella penisola di Huon si distingue facilmente dalle altre grazie alla caratteristica fascia pettorale gialla. Anche il Lorichetto della Duchessa, allopatico (5), presenta una fascia pettorale gialla. Può essere difficile distinguere sul campo le tre specie appartenenti al genere Charmosyna presenti in Nuova Guinea, il Lorichetto delle fate , il Lorichetto di Giuseppina e il Lori di Papua, soprattutto perché sono visibili solo per brevi istanti e, il più delle volte, in volo. Il Lori di Papua è evidentemente più grande del Lorichetto delle fate e si trova prevalentemente ad altitudini superiori (il Lorichetto delle fate solitamente fino a 1800m, il Lori di Papua principalmente da 1500m in su). Il Lorichetto delle fate non ha le lunghe e filiformi timoniere esterne tipiche del Lori di Papua né la grande macchia nera che caratterizza tutte le fasi cromatiche normali. Il Lori di Giuseppina, che si trova principalmente fino a 1200m, ma talvolta anche fino a 2000m, è più difficile da distinguere ma oltre a non avere le lunghe e filiformi timoniere esterne del Lori di Papua, ha la superficie superiore della coda di colore rosso anziché verde: esemplari con le timoniere spezzate o immaturi dal piumaggio meno vivace di Lori di Papua possono essere difficili da identificare al di fuori di Vogelkop, dove hanno le parti inferiori striate di giallo; tuttavia il profilo in volo rimane inconfondibile, con il collo lungo e ali sottilissime dalle remiganti primarie allungate. Le forme melanistiche del Lori di Papua sono estremamente caratteristiche e difficilmente rischiano di essere confuse con altre specie, sebbene ci siano esemplari appartenenti ad una fase intermedia. Le altre simpatriche (6), il Lorichetto guance viola , il Lorichetto alpino , il Lorichetto di Musschenbroek minore e il Lorichetto di Goldie, difficilmente possono essere confusi con il Lori di Papua. Il volo di questa specie è diretto ma non veloce, caratterizzato da colpi d’ala rapidi che producono un frullio ben udibile. Secondo alcuni esperti la frequenza con cui ricorrono gli esemplari melanistici dipende dall’altitudine e dalla zona, ma non esistono studi sistematici in proposito.

Il richiamo in volo è un singolo e sonoro queeea, legato e più stridente rispetto ai richiami del Lorichetto guance viola e del Lorichetto alpino, entrambi simpatrici. Mentre mangia emette una nota nasale e placida di tonalità costante e volume crescente, descritta come un wnnaaah o nreeennn. Emette anche altri richiami, tra cui un lieve cheep…cheep e un taa-aan nasale e prolungato quando riposa,o quando si sposta tra le cime degli alberi e durante le attività di toelettatura.
Rilievi centrali della Nuova Guinea in Irian Jaya (Indonesia) e Papua Nuova Guinea, si trova dalla zona sud orientale di Vogelkop fino alla catena Adelbert, Penisola di Huon e rilievi sudorientali. Secondo le stime, la popolazione mondiale, stabile, è superore a 500.000 individui. Si ritiene che né la cattura a scopo commerciale né la caccia a questi esemplari, le cui penne sono molto ricercate per la decorazione di copricapo tribali, costituiscano attualmente una minaccia per lo status di questa specie.

La coppia melanica
Si trova a partire dai 1200m fino al limite della vegetazione arborea e ne è stata segnala la presenza fino a 3500m, ma è più comune al di sopra dei 2000m, raro al di sotto dei 1500m; è stato visto da Forshaw a 2800m d’altitudine in una foresta di Nothofagus-Podocarpus. Agile e dal comportamento attivo, si trova spesso in coppia o piccoli gruppi. Questi esemplari si spostano tra gli alberi, a scatti con movimenti non fluidi, spesso schioccando le timoniere esterne lunghe e affusolate; nonostante questo, non sono particolarmente vistosi tra gli alberi. Il Lori di Papua si nutre di nettare, polline, forse di fiori, boccioli, frutti e piccoli semi sugli alberi con le gemme o sulle piante epifite in fiore, rimanendo attaccato ai rami coperti di muschio. Talvolta ingerisce anche accidentalmente, larve di insetti. Si trova negli alberi e nelle piante Schefflera in fiore, spesso in compagnia di altre specie che si nutrono di boccioli, come il Lorichetto di Musschenbrioek minore. Spesso viene visto volare basso al di sopra degli alberi o attraversare le radure a media altezza. Non esistono descrizioni del comportamento in nidificazione in natura, ma H.D.Pratt nel 1987 (7), osservò un adulto muoversi con circospezione in prossimità di un folto gruppo di piante epifite, probabilmente alla ricerca di un sito adatto alla nidificazione. Inoltre, nel mese di agosto venne raccolta una coppia in livrea nuziale e esemplari giovani sono stati visti in natura nei mesi di ottobre e novembre. In cattività, quando depone due uova, la cova dura tre settimane e i piccoli rimangono nel nido per circa due mesi. Durante il rituale del corteggiamento, gli esemplari della sottospecie nominale drizzano le penne gialle dei calzoni, si allungano e si stirano, si piegano, fischiano e con il becco producono un rumore simile a uno schiocco. Ha testa rossa con macchia nera sulla parte posteriore del vertice e macchia a forma di mezzaluna sulla nuca; macchia sul vertice con macchiette blu che scende verso il basso partendo dal margine posteriore. Parte inferiore della nuca e mantello rosso uniforme; centro del dorso verde smeraldo scuro; parte inferiore del dorso rosso acceso; groppone azzurro brillante. Parte superiore delle ali verde smeraldo scuro con remiganti dal vessillo interno nero; sottoala grigio antracite con copritrici rosse; verdi le copritrici marginali. Gola rossa, petto di tonalità più scura e leggermente meno vivace; parte inferiore del petto rosso più chiaro con macchia nera di dimensioni variabili al centro del petto che, talvolta, si estende fin sui calzoni; lati del petto e fianchi con due serie evidenti di striature gialle; basso ventre e sottocaudali di colore rosso. Sopraccoda verde che sfuma gradatamente nell’arancio delle timoniere, rachide delle penne centrali nero bruno; sottocoda giallo che sfuma nell’arancio delle timoniere. Parti nude: becco arancio; iride arancio; zampe arancio. Sessi simili nella nominale. Nell’immaturo il piumaggio è meno vivace rispetto all’adulto e le timoniere sono più corte. Variabile barra alare gialla sulla parte inferiore delle remiganti secondarie; groppone screziato di verde; punte delle remiganti primarie meno allungate rispetto all’adulto. Becco e zampe arancio tendente al marrone; iride giallo pallido.
dimensioni
Lunghezza 36-42 mm; Ala 130-145; coda 200-252; becco 15-17; tarso 16-18. C.papou
Lunghezza 45 cm; Ala 134-151 mm. C.p.stellae.
Lunghezza 45 cm; Ala 135-156 mm. C.p.goliathina
Lunghezza 42 cm; Ala 120-142 mm. C.p.whanesi.
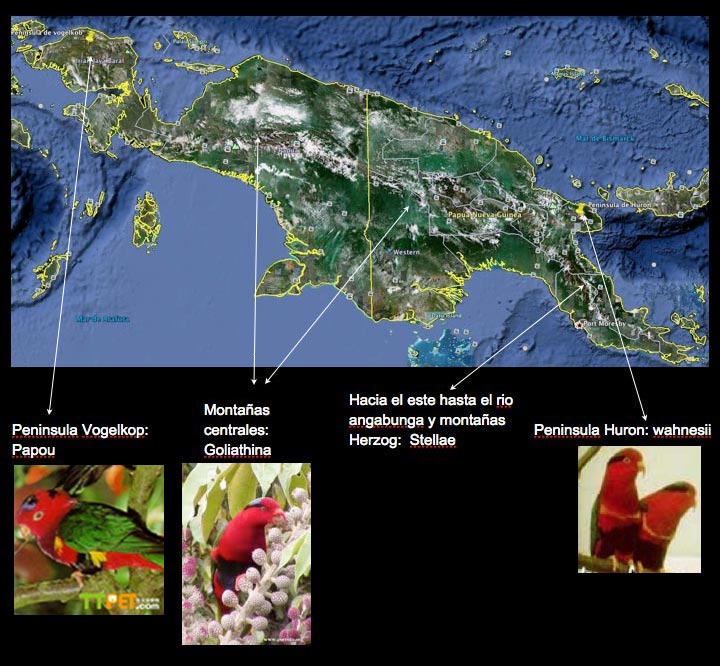
tre sottospecie, più la nominale:

C.p. papou, Scopoli, 1786. Frequenta i rilievi della penisola del Vogelkop.
C.p. stellae , A.B.Mayer, nel1886, nominò tale uccello in onore della Baronessa Stella Erggelet, patrona austriaca della scienza. Presente sui rilievi di Nuova Guinea sud orientale sino al fiume Angabunga e le montagne Herzog. In questa sottospecie, maschio e femmina sono differenti, ed è presente una fase melanistica. La fase normale della sottospecie stellae, rispetto alla nominale, porta una macchia nera sulla nuca molto più estesa -che raggiunge l’occhio-, con striatura anteriore piuttosto marcata di colore blu violaceo; quest’unica evidente macchia nera sostituisce le due meno appariscenti zone nere che caratterizzano vertice e nuca della nominale. Anche le timoniere esterne lunghe e filiformi sono diverse, poiché la loro colorazione sfuma dal verde all’arancio rosso (anziché all’arancio) ed infine, sulle punte, al giallo. Inoltre, la C. stellae non ha l’evidente striatura gialla su petto e fianchi della C. papou e la sua macchia nera sul ventre si estende fin sui fianchi. La femmina mostra un’evidente macchia gialla sulla parte inferiore del dorso con punte verdi sulle penne più lunghe, e sopracoda rosso (il maschio ha groppone rosso con macchia blu). Più uniforme il rosso sul petto, non di una tonalità più scura sulla parte superiore. Nella fase melanistica il rosso è sostituito in larga misura dal nero . Si distingue dalla sottospecie goliathina grazie al diverso colore delle lunghe e filiformi timoniere esterne. Negli esemplari giovani le parti inferiori sono caratterizzate da sottili orli più scuri.
C.p. goliathina, Rothschild,e Hartert, 1911. Rilievi della Nuova Guinea occidentale, centrale e orientale, Montagna di Goliath. In questa sottospecie, maschio e femmina sono differenti, e sono presenti due fasi melanistiche. La fase cromatica normale è simile alla stellae da cui si distingue grazie alle punte gialle che caratterizzano le timoniere esterne lunghe e filiformi (anziché arancio rosso che sfuma in giallo). Le sopracaudali più lunghe sono blu malva, anziché rosse come nella stellae. Come quest’ultima, invece, la fase melanistica ha parti superiori verdi e parti inferiori, testa e mantello completamente blu scuro, quasi nero, interrotto solo dalle striature blu sulla nuca; il maschio ha dorso e sottocaudali di colore rosso (il blu sul groppone è presente in entrambi i sessi). Le ali sono verdi e le remiganti hanno vessillo interno nero. Il sottocoda è più giallo verde rispetto a quello della fase cromatica normale, e le timoniere esterne lunghe e filiformi sono verde spento che sfuma nel giallo verde delle punte.
C.p. wahnesi, Rothschildi, 1906, stà per C.Wahnes; questo Lori era stato catturato nel gennaio del 1906 da Carl Wahnes, naturalista e collezionista tedesco che ha lavorato sulle montagne della penisola di Huon nord-est della Nuova Guinea. Lord Rothschild nominò anche Parotia wahnesi, l’uccello del paradiso da lui scoperto, in onore di Wahnes. Detto lori è distribuito sui rilievi della penisola Huon e montagne Adelbert, comprese tra i 1400 m i 3500 m, occasionalmente si porta a quote più basse intorno i 1200m. Piuttosto comune in molte località, dove vive in coppia o in piccoli gruppi, talvolta si unisce ad altre specie di Lori, ma solo in occasione per consumare pasti e nettare florescenze, bacche e larve. Simile alla goliathina, ma con una sottile striscia gialla che demarca il rosso sulla parte inferiore del patto. Presenta una slavatura verde sui fianchi e sulla parte superiore del ventre. Parte centrale del ventre e sottocaudali di colore rosso.
Note esplicative:
(1).Il Vogelkop Montane rain forest, Penisola capo dell’uccello, si sviluppa nella parte nord-occidentale della Nuova Guinea e per la maggior parte su Papua occidentale.
(2) Epifitiche,sono quelle specie di piante che vivono su alter piante e le usano come sostegno..
(3) Melanico,è un eccesso di pigmentazione nero o quasi nero della pelle , piume , o peli.
(4) Allopatrico,si dice di specie residenti in regioni diverse geograficamente separate.
(5) Tenebrio, tarma della farina insetto dell’odine dei coleotteri e della famiglia dei tenebrionidi.
(6) Simpatrico, allorquando due specie vivono nella medesima area e possono venire a contatto.
(7) Waigiou, chiamata anche Amberi o Waigeo, è la più grande delle quattro isole dell’arcipelago Raja Ampat,Indonesia.
(8) T.K..Pratt, Birds of Nuova guinea,1986,Princeton UniversityPress.

Testo Guglielmo Petrantoni
Impaginazione grafica by GRAFOS SERVIZI GRAFICI – SAN COLOMBANO AL LAMBRO
 Amazona farinosa chapmani (© Guglielmo Petrantoni)
Amazona farinosa chapmani (© Guglielmo Petrantoni)

























 La sua dieta comprende le parti di Cordia sulcata, Clusia, Sloanea, Dacryodes excelsa, Ficus, Cecropia peltata, Mangifera indica, Melisoma vrescens, Euterpe, Ixora ferrea, Micropholis chrysophylloides, Acrocomia aculeata, Simaruba amara, Krugiodendron ferreum, Dussia martinicensis, Andira inermis, Inga ingoides, Byrsonima coriacea, Talauma dodecapetala, Chione verosa, Psidium Guajava e Aphanes erosa; tra tutte predilige la Pouteria multiflora. Nidifica nelle cavità del tronco di alberi maturi, ad esempio in grandi esemplari di Dacryodes o Sloanea. Il corteggiamento inizia a febbraio; depone le uova in aprile-maggio ma negli anni di siccità in gennaio-febbraio o addirittura in luglio. In caso di piogge particolarmente abbondanti, non si riproduce affatto. Depone solitamente due uova, raramente tre. Il tasso di natalità è molto basso con il 50% dei nidi che non produce alcun piccolo e il restante 50% da cui nascono non più di due esemplari.
La sua dieta comprende le parti di Cordia sulcata, Clusia, Sloanea, Dacryodes excelsa, Ficus, Cecropia peltata, Mangifera indica, Melisoma vrescens, Euterpe, Ixora ferrea, Micropholis chrysophylloides, Acrocomia aculeata, Simaruba amara, Krugiodendron ferreum, Dussia martinicensis, Andira inermis, Inga ingoides, Byrsonima coriacea, Talauma dodecapetala, Chione verosa, Psidium Guajava e Aphanes erosa; tra tutte predilige la Pouteria multiflora. Nidifica nelle cavità del tronco di alberi maturi, ad esempio in grandi esemplari di Dacryodes o Sloanea. Il corteggiamento inizia a febbraio; depone le uova in aprile-maggio ma negli anni di siccità in gennaio-febbraio o addirittura in luglio. In caso di piogge particolarmente abbondanti, non si riproduce affatto. Depone solitamente due uova, raramente tre. Il tasso di natalità è molto basso con il 50% dei nidi che non produce alcun piccolo e il restante 50% da cui nascono non più di due esemplari.
