Amazzone di St. Vincent
Altri nomi: amazzone di Saint Vincent (I), Koenigsamaqzone (D) , Papagaio de sao vicente (Portoghese).

Amazona guildingii (Vigors 1837).
Amazzone di grandi dimensioni con faccia e vertice bianco sporco o giallo pallido; la colorazione del piumaggio è molto variabile e distingue due fasi cromatiche fondamentali: la più comune è marrone dorato, la più rara è verde. La coda ha la punta gialla e ampia banda subterminale blu; in volo è ben visibile il giallo sulle copritrici della parte inferiore dell’ala e quello alla base delle remiganti. La maggior parte degli esemplari ha del blu sul retrocollo o ai lati della parte posteriore del vertice. L’Amazzone di St. Vincent è l’unico psittacide all’interno del suo areale e anche in cattività difficilmente rischia di essere confusa con altre specie. È piuttosto vistosa durante le prime ore del mattino, alla sera e appena dopo mezzogiorno. Negli altri momenti della giornata rimane silenziosa nella canopea, impegnata nella raccolta del cibo o nella toelettatura. Spesso quieta e taciturna quando piove. Si alza in volo facendo molto rumore e, in volo, è appariscente e rumorosa. Il volo è veloce e diretto, caratterizzato da colpi d’ala molto energici.

Emette una grande varietà di richiami, gridi e strilli gutturali screee-eee-ah che ricordano il suono della tromba, gridi che ricordano il richiamo dell’anatra, uno scree-ree-lee-leee penetrante e stridulo, suoni brevi e gorgoglianti simili al verso del cane, suoni aspri e stridenti draaak e sceeeet. In volo emette un sonoro quaw quaw quaw. Alcuni richiami sono molto complessi e si articolano su trilli, gridi acuti e sonori, fischi e strilli. Quando si nutre emette un suono che ricorda un alterco tra persone.

Il cartellone indicativo di onservazione della Amazona guildingii
Specie endemica dell’isola di St. Vincent nelle Piccole Antille. La sua distribuzione è strettamente legata alla presenza di foresta umida originaria che, per gran parte del XX secolo, è stata confinata sui versanti orientale e occidentale del crinale centrale dell’isola. Oggi è numerosa all’inizio delle valli Buccament, Cumberland, Colonaire, Congo Jennings-Perseverance e Richmond, dove si concentra gran parte della foresta orignaria superstite; sul resto dell’isola si trova in numeri molto più modesti. Nonostante molte delle stime riguardanti i numeri di questa specie tra il 1870 e il 1920 non siano concordi, è evidente il calo che si è verificato intorno agli anni Cinquanta del secolo scorso. All’inizio degli anni Settanta la popolazione contava da poche centinaia a un migliaio di esemplari. Uno studio del 1982 ipotizzò l’esistenza di 421±52 esemplari, mentre una stima del 1988 ne suggerì 440-500; la popolazione contava forse 800 esemplari nel 1994. Il calo della popolazione e la contrazione dell’areale dipendono dalla perdita dell’habitat e dalla scomparsa della foresta umida che, in passato (almeno sul versante occidentale), quasi raggiungeva il livello del mare. La deforestazione sembra avere subito una battuta d’arresto almeno in alcune delle valli ma l’habitat è comunque a rischio a causa della selvicoltura, dell’espansione delle piantagioni di banane, della produzione di carbone, della scomparsa di siti adatti alla nidificazione e dell’attività commerciale che interessa i piccoli trafugati nei nidi. Nel 1984 della foresta originaria sopravvivevano appena 16km2. le attività di caccia e cattura che alimentano il commercio locale e quello internazionale hanno rappresentato tra la fine degli anni Cinquanta e gli anni Settanta la minaccia principale alla sopravvivenza della specie, ma oggi sono tenute sotto controllo; gli effetti degli uragani, oltre ad essere causa diretta di mortalità tra gli esemplari di questa specie, mettono a dura prova la sua sopravvivenza anche causando la scomparsa delle piante che sono alla base della sua alimentazione e che forniscono i siti privilegiati per la nidificazione. Nel 1902 gran parte dell’habitat preferenziale dell’Amazzone di St. Vincent è stato distrutto dall’eruzione del Mount Soufriere ed è evidente che eventuali eruzioni future potrebbero minare ulteriormente la sopravvivenza della specie. Parte dell’habitat rimanente rientra nelle aree protette e la specie stessa è protetta dalle leggi locali. CITES appendix I. VULNERABILE.

Questa specie si trova prevalentemente in foresta matura montana, tra i 125m e i 1000m d’altitudine ma, dove ancora sopravvive, preferisce le foreste a bassa quota. Occasionalemente lascia la foresta per raggiungere le zone coltivate e i giardini. Gregaria, si trova solitamente in stormi composti da 20-30 esemplari o in coppia. Si nutre in stormo e si posa in comunità. Durante la stagione della riproduzione difende l’area circostante il nido ma si riunisce comunque in gruppi che contano una dozzina di esemplari quando si nutre e sui posatoi.
 La sua dieta comprende le parti di Cordia sulcata, Clusia, Sloanea, Dacryodes excelsa, Ficus, Cecropia peltata, Mangifera indica, Melisoma vrescens, Euterpe, Ixora ferrea, Micropholis chrysophylloides, Acrocomia aculeata, Simaruba amara, Krugiodendron ferreum, Dussia martinicensis, Andira inermis, Inga ingoides, Byrsonima coriacea, Talauma dodecapetala, Chione verosa, Psidium Guajava e Aphanes erosa; tra tutte predilige la Pouteria multiflora. Nidifica nelle cavità del tronco di alberi maturi, ad esempio in grandi esemplari di Dacryodes o Sloanea. Il corteggiamento inizia a febbraio; depone le uova in aprile-maggio ma negli anni di siccità in gennaio-febbraio o addirittura in luglio. In caso di piogge particolarmente abbondanti, non si riproduce affatto. Depone solitamente due uova, raramente tre. Il tasso di natalità è molto basso con il 50% dei nidi che non produce alcun piccolo e il restante 50% da cui nascono non più di due esemplari.
La sua dieta comprende le parti di Cordia sulcata, Clusia, Sloanea, Dacryodes excelsa, Ficus, Cecropia peltata, Mangifera indica, Melisoma vrescens, Euterpe, Ixora ferrea, Micropholis chrysophylloides, Acrocomia aculeata, Simaruba amara, Krugiodendron ferreum, Dussia martinicensis, Andira inermis, Inga ingoides, Byrsonima coriacea, Talauma dodecapetala, Chione verosa, Psidium Guajava e Aphanes erosa; tra tutte predilige la Pouteria multiflora. Nidifica nelle cavità del tronco di alberi maturi, ad esempio in grandi esemplari di Dacryodes o Sloanea. Il corteggiamento inizia a febbraio; depone le uova in aprile-maggio ma negli anni di siccità in gennaio-febbraio o addirittura in luglio. In caso di piogge particolarmente abbondanti, non si riproduce affatto. Depone solitamente due uova, raramente tre. Il tasso di natalità è molto basso con il 50% dei nidi che non produce alcun piccolo e il restante 50% da cui nascono non più di due esemplari.
Colorazione del piumaggio molto variabile: nelle tavole sono illustrate la fase marrone dorato e la fase verde, mentre di seguito viene descritta solo la fase marrone dorato. Fronte, redini, regione del sopracciglio e parte superiore delle guance bianco sporco; vertice giallo; penne su parte posteriore e lati del collo blu pallido con macchia blu scura al vertice, penne sulla nuca verdi con macchia nerobruno al vertice. Parti superiori marrone scuro con macchie più scure al vertice di alcune penne. Scapolari marrone dorato; remiganti primarie esterne con vessillo esterno blu spento; resto delle copritrici alari marrone con banda sub terminale verde e macchia scura al vertice di alcune penne; margine carpale giallo arancio con verde infiltrato. Remiganti primarie blu con base giallo arancio; dello stesso colore le remiganti secondarie esterne con banda sub terminale verde, remiganti secondarie interne verdi con macchia blu al vertice; remiganti terziarie interne verde scuro sfumato di marrone dorato sul vessillo esterno, remiganti terziarie esterne con base verde, progressivamente blu oltremare procedendo verso la punta. Sottoala con piccole copritrici marrone e macchia verde al vertice, grandi copritrici secondarie gialle, remiganti nero bruno con base gialla. Penne della gola arancio con punta blu o verde azzurro; parte superiore del petto marrone dorato con macchia marrone scuro al vertice delle penne cui si deve il disegno barrato; ventre di un marrone dorato più tendente al giallo rispetto al petto, con banda sub terminale verde e macchia nerobruno al vertice di alcune penne; sottocaudali giallo verde. Base della coda arancio con ampia banda blu al centro e ampia punta giallo brillante. Parti nude: becco color corno pallido tendente al grigio; iride arancio; zampe grigie.

Un gruppo famigliare.
Sessi simili. Nell’immaturo la colorazione è meno vivace.
Ala 25,3-27,5 cm.; coda 14,8-17 cm.; becco 3,2-3,9 cm.; tarso 2,7-3,1cm.
È possibile forse distinguere da un punto di vista genetico gli esemplari che si trovano nella parte orientale di St. Vincent (sopravento) da quelli che occupano la parte occidentale dell’isola (sottovento): la piccola popolazione orientale (solo 83 esemplari nel 1982) oltre ad avere la voce più acuta, sembra presentare una percentuale maggiore di esemplari appartenenti al morfo verde.












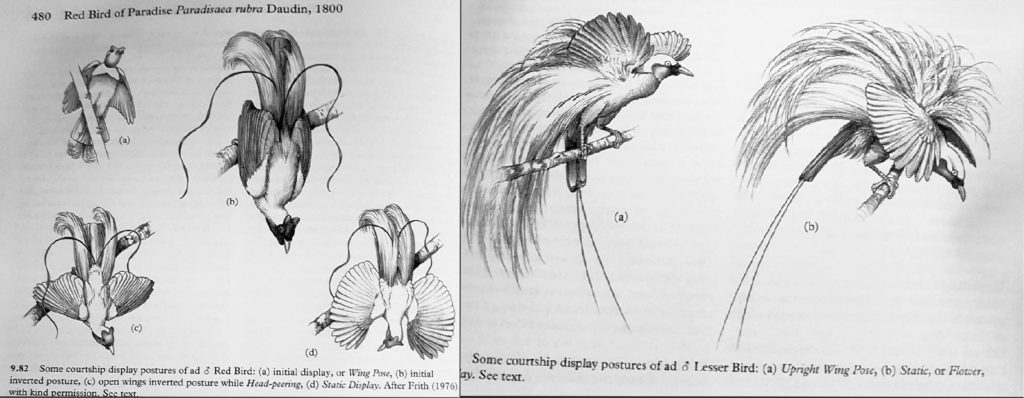
 Tanto preso dalla frenesia del ballo, nulla riesce a distrarlo, in questo momento si apre il tunnel per favorire il passaggio verso la femmina o viceversa, la quale assisteva colpita alla parata; Maschio e femmina restano assieme solo per un breve tempo, quel tempo per consumare il “pasto”. Effettuato il passaggio in voliera unica, essi restano ancora insieme per due o tre giorni, poi vengono divisi nuovamente. Il maschio in natura riprende le sue danze per cercare di attirare più femmine e copulare nuovamente, ma è noto comunque che il maschio esaurisca il suo amore nello sfoggio della propria bellezza e sia poi completamente dimentico dei doveri di padre; pertanto tutto ciò che concerne la cura della prole, la costruzione del nido fino al nutrimento dei piccoli, ricade unicamente sulle “ali” della femmina.
Tanto preso dalla frenesia del ballo, nulla riesce a distrarlo, in questo momento si apre il tunnel per favorire il passaggio verso la femmina o viceversa, la quale assisteva colpita alla parata; Maschio e femmina restano assieme solo per un breve tempo, quel tempo per consumare il “pasto”. Effettuato il passaggio in voliera unica, essi restano ancora insieme per due o tre giorni, poi vengono divisi nuovamente. Il maschio in natura riprende le sue danze per cercare di attirare più femmine e copulare nuovamente, ma è noto comunque che il maschio esaurisca il suo amore nello sfoggio della propria bellezza e sia poi completamente dimentico dei doveri di padre; pertanto tutto ciò che concerne la cura della prole, la costruzione del nido fino al nutrimento dei piccoli, ricade unicamente sulle “ali” della femmina.










